“其实国家食药监总局也不想通过‘集中审评’的方式解决药品审评积压问题”,一位接近国家药品审评中心(CDE)的人士告诉《E药经理人》,CDE主任许嘉齐曾在多种场合表示,不会通过运动式的方式解决积压。但这并不影响当下集中审评紧锣密鼓的进行。
此轮集中审评是从7月31日国家食药监总局(CFDA)就《关于征求加快解决药品注册申请积压问题的若干政策意见》公开征求意见开始的。文件提出对积压的同品种实行集中审评。具体来说,就是对已受理的同品种,按统一的审评标准和尺度组织力量进行集中审评。对不合规的,及时做出不予批准的决定;合规的按申报顺序依次审评发文。
此后,CFDA在8月5日下发《关于进一步规范药品注册受理工作的通知》,正式拉开了“通过提高标准,设定流水化作业方案,进行科学严谨的筛选,合理提高审评质量”的集中审评大幕。
8月18日,国务院发布《关于改革药品医疗器械审评审评制度的意见》,把“消化完积压存量,尽快实现注册申请和审评数量年度进出平衡”的时间定在了2016年底,把“实现按规定时限审批”的时限定在2018年。
CFDA对解决积压集中审评一直有个屡试不爽的杀手锏,用CFDA副局长吴浈公开的说法:运用集中审评这种行政措施“削峰”。
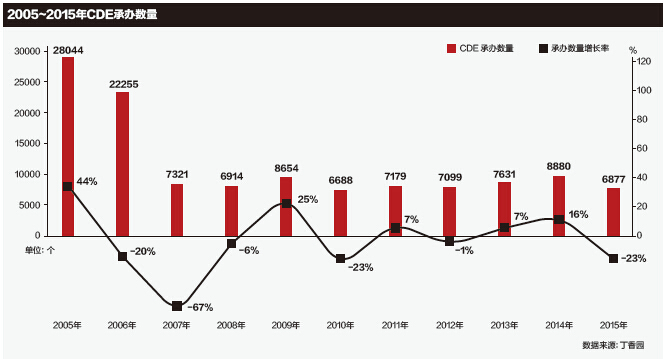
其实,CFDA曾在2005年和2008年进行过两次大规模集中审评。但没有阻挡住第三次积压高峰的到来。这也让人们普遍怀疑,此次集中审评的“削峰”到底能否实现既定目标?下一次积压高峰会不会再次出现?
法同因不同
“药品注册审评积压是历史造成的。”吴浈在8月18日国务院新闻发布会上表示,药品审评在2000年以前都是由各省承担,所以药品审评量都在各省分散。2000年以后,国家对审评方式进行了改革,全部归到CFDA,审评量增加,但相应的人员力量没有跟上,由此药品审评积压问题始终存在。
2005年是积压的第一次高峰,当时“积压数量超过17000件”。虽然制药企业对审评积压有怨言,但这并非是促成集中审评的关键原因。一位参加过第一次集中审评的北京市药检所的工作人员告诉《E药经理人》,主要是当时出现了一系列的药害事件,舆论导向普遍认为是审评不严导致。因此国家要求从药害源头进行清理、整顿。所以那次集中审评更多地是为了解决申报中的乱象问题。
当时主要调集了各省药检所人员和相关科研院所数百人参与集中审评。这些审评人员的主要精力放在资料造假上。上述药检所工作人员表示,当时药品申报造假水平比较低级。如提供药物稳定性资料时,很多药物图谱一图多用情况十分普遍。在流程上,集中审评以问题为导向,将所有资料集中,然后针对资料中的问题进行集中筛查。
经过那次集中审评,CDE发现问题主要存在于几个方面,一是技术指导原则、申报资料要求不全面、系统和具体;二是部分技术要求偏低;药企在实际操作过程中存在“重终点,轻过程”、“重限度,轻方法”等问题。
后来,CFDA先后颁布了《化学药原料药制备和结构确证研究的技术指导原则》、《化学药物制剂研究技术指导原则》等13项与药学研究相关的技术指导原则。从而建立起了药学研究技术规范的框架。另外,也引入了一些国际通行的技术要求和标准,初步展现了过程控制和终点控制相结合的质量控制理念。
此后,药品申报数量出现了一小段时间的放缓。但维持不到3年,积压数量再次出现高峰,达到了27000件。
业内人士指出,当时之所以出现大量积压,与当时国家药品监督管理局(SFDA)局长郑筱萸落马有关。由于要求对其在任时的一些获批的药品进行重新审批。CDE只好再次启动集中审评。
此次集中审评被SFDA称之为“过渡期集中审评”,而且还发布了《关于印发过渡期品种集中审评工作方案的通知》。对于过渡期集中审评的品种也划定了范围,主要包括2007年10月1日前已由SFDA受理,但尚未完成审评的;原《药品注册管理办法》所界定的中药注册分类8、9类注册申请;化学药品注册分类5、6类注册申请。
在具体的执行上,不仅确定了集中审评的阶段性工作,还给出的具体的时间表。第一阶段为对比资料阶段(2008年1月?4月),组织审评技术人员对过渡期品种申报的药学、药理毒理以及临床试验资料进行对比,筛选出资料雷同、内容重复、数据编造的注册申请,进一步解决申报资料的真实性问题;第二阶段为技术审评阶段(2008年4月?9月),组织药学、医学和其他技术人员按照药品注册审评程序,以药品注册相关技术指导原则和审评要点为基础,进一步细化和完善技术标准,采取专家会议的方式集中进行技术审评,严格执行标准,统一把握尺度,着重解决申报中的科学性问题。
经过一年的努力,在2.5万个过渡期申报件中,审评结论为“批准”的有9200个,占总数的37%;结论为“不批准”的有1.53万个,占总数的60%。值得注意的是,当时监督企业主动撤回的有8000多个,其存在的问题是“药品研制不规范和弄虚作假行为”。
此后,为了避免弄虚作假行为,CFDA再次仿照国际通行办法,规范申报资料,提倡电子提交,审评报告与综述资料有机结合。
然而,这些技术上的修修补补并未阻挡住第三次积压高峰的来临。对此,业内人士表示,一方面随着发展和积累,国内药企的研发实力在近5年突飞猛进。另一方面,审评力量并未加强,人员仅仅只有120人左右。为了完成“用3年解决审评积压”的承诺,CFDA只好再祭出“削峰”计划的集中审评大旗。
重火力集结于临床
在第三次集中审评开始之前,CFDA发布了《关于开展药物临床试验数据自查核查工作的公告》(以下简称“核查公告”),列出了1622个受理号企业清单,要求企业进行自查。一个月后,CFDA公布了结果:主动撤回注册的申请317个,占20%。
对于“20%的主动撤回”,业界有两种戏谑说法:一种是“一临床自查就有20%撤回”,另一种是“临床自查才20%撤回”。
据悉,CFDA对20%的比例并不满意。一位接近CFDA的人士表示,撤回数量低于总局期望值。因为第二次集中审评时,主动退回申报的数量占积压总量的30%以上。
经过企业自查之后,CDE将第三波集中审评的主要精力放在了临床资料的审评上。
对CDE的做法,有专业人士表示“有高人支招”。上述药检所人员表示,经过前两次集中审查,企业在药学内容方面的造假能力越来越高。他此前与许嘉齐交流时认为,“如果要进行药学筛查,随着造假技术提升,核查起来速度比较慢。而临床数据造假问题现在还很低级,很容易核查出真假。”
参加两个月集中审评的药检人员发现,此次审评工作强度很大,基本是连轴转。前两次集中审评时周六日还可以休息,现在完全没有休息的时间。在CDE的审评资源向验证性临床实验倾斜后,自8月份以来,申请临床受理号的审结数量有了大幅提升。而且值得注意的是 ,9月份的临床通过率却仅为36%,较之前有明显下降。
除了验证性临床集中审评让企业心跳不已之外,仿制及改剂型申请(ANDA)的集中审评也是突飞猛进。Insight数据库显示,进入集中审评的验证性临床序列中,30%受理号队列序列号前进了700多位。而ANDA序列中,超过50%的受理号队列序号前进了1000多位。还有受理号忽然前进了1600多位。
另外,此次集中审查在验证性临床发力,也一改前两次集中审评中出现造假问题,只是毙掉项目的简单做法,而是痛下重拳。在通告自查结果时CFDA表示,通过临床自查,对于应该企业自行撤回申报而没有撤回的,在进入集中审评后,会对完成自查治疗填报的药品注册申请进行逐一临床试验数据核查。若核查中发现弄虚作假问题,会及时立案调查,其注册申请将不予批准,调查结果也会向社会公开。
同时,CFDA还强调,对核查中发现临床试验数据真实性存在问题的相关申请人,3年内不受理其申请。并将弄虚作假的申请人、临床试验机构、合同研究组织以及相关责任人员等列入黑名单。弄虚作假的直接责任人参与研究或组织研究的临床试验资料,10年内不予受理。
业内人士对CFDA此次重拳出击表示欢迎,认为此前之所以一次次出现积压高峰,其中一个主要原因就是造假成本太低,以至于审评人员将大量的时间浪费在了没有价值的资料上,无暇顾及真正做研发的“老实人”。
会出现下一次峰值吗?
“这次参与集中审评的人员除了来自CDE,其他全部来自于各省药监局的审评中心。”上述药检所人员表示。这表明CFDA有意培养各省局的审评力量,为接下来彻底扭转审评积压做准备。
CDE审评人员数量不足也是国内药品审评积压的主要原因之一。每年全国企业申报的药品注册批件数量在8000?10000件,但审评人员只有120人,这种数字矛盾一直是吴浈心中的痛点。
8月27日,CFDA官网发布招聘公告,拟招聘主审审评员18人,审评人员51人。如果此次招聘顺利完成,该局技术审评人员将达到158人。而且,此次招聘中还明确了薪酬待遇,主审审评员年薪20万?40万元,审评员年薪10万?25万元。
除了自身扩军之外,借助各省药监局的力量也是CFDA选择。据悉,上海市将会组建CFDA药品审评中心上海分中心,以推进药品审评制度改革。
当然,当下最令人头疼的是仿制药重复申报的问题。吴浈表示,在21000个品种中,80%的是化药仿制药。其中有8个品种,有100多家企业申报;23个品种,有50?99家企业申报,89个品种,重复申报的企业有20?49家。
振东药业的一位研发人员告诉《E药经理人》,其实企业也不想重复申报,但是在当下审批流程中,这一现象很难避免。一般而言,企业申报药品研发项目,首先得将申报资料报到省药监局,等通过省药监局的各种审查、核查之后才报至CDE。这期间,由于信息不公开、不透明,最终造成的结果是,到了CDE时,才知道很多企业已经在排队。但此时项目已经上马,企业已经投入了大量资金准备,骑虎难下,只能等待审评结果。
当然,如今的集中审评对行业整体而言,是一大利好。但从公平性的角度而言,也有失于偏颇之嫌。特别对那些最早申请,等待三五年的企业而言显得不公平。据悉,仅阿齐沙坦一个品种就有51家企业在这两个月内同时结束了药理、毒理和临床专业审评,这里面的企业有些早在2012年就已经申报,有的2015年才递交申请。
虽然,此前吴浈反复强调此次审评改革不会头痛医头,脚痛医脚,实施的是综合改革,“是全方位的”。但业内人士还是担心,下一次积压高峰还会出现。因为虽然《国务院关于改革药品医疗器械审批审评制度的意见》提出了12项改革任务,但由于缺乏落地细则,有专家表示,“按规定时限审批”的要求至少在3?5年内难以实现。
“对比CFDA与FDA发展史,你会发现,FDA犯过的错,CFDA一个都不会拉下。因为不犯错误,很难真正促进一些法规的制定”。