根据FDA新药审评总结报告,2015年制药企业新药申报数量保持稳定,但FDA批准数量有较大提升,共有45个新药获得批准,包括按照新药审评(NDAs)的新化合物(NMEs)和按照生物药审评(BLAs)的新生物制剂。2006-2015年新药申报和批准情况如下表所示。
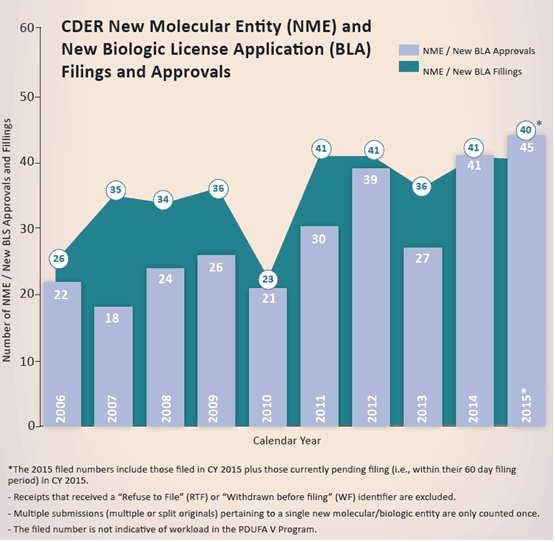
基于统计,我们发现了以下有趣的现象:
1.2015年批准的新药中,约 47%(45个中的21个)用于治疗罕见疾病(在美国病例数少于20万);
2.采用了多种法规方法来加快新药审批速度,包括快速通道(Fast Track),重大突破项目(Breakthrough),优先审评(Priority Review)和加速审批(Accelerated Approval)。其中 27个新药 (60%) 采用了1种以上方法来加快药物的开发或者审评速度。
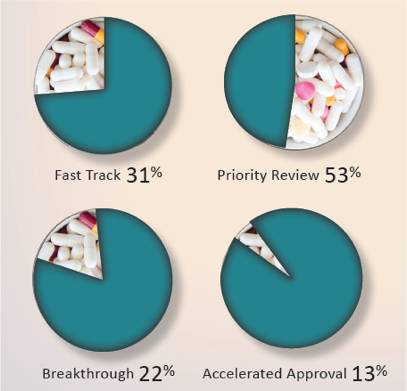
*这4种快速审评方法并不互相排斥,不少产品采用了多种方法(比如 Alecensa? 采用了Breakthrough 和Priority Review,Darzalex?采用了4种加速方法)。
3.按照美国抗生素GAIN 法案(Generating Antibiotics Incentives Now),2个新药被划分为QIDP(Qualified Infectious Disease Products),因此得以进入快速审批通道。
4.87% 的药物(45个中的39个) 在第一轮审评中即被批准上市。
505(b)(2)新药批准情况
根据Camargo公司数据库统计,2014年按照505(b)(2)途径批准了41个药物,2015年保持强劲势头,44个药物得到批准。下图为2004-2015年按照505(b)(2)途径批准药物情况。
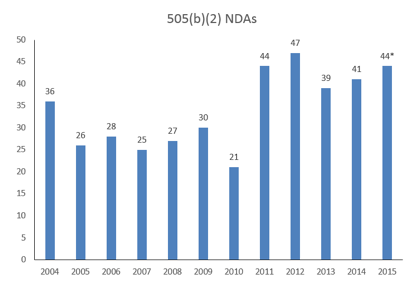
可以发现,按照505(b)(2)途径批准的药物数量与新药批准的数量基本相当,分别为44个和45个。在45个新药中,有4个是通过505(b)(2)途径批准的,如下图所示。
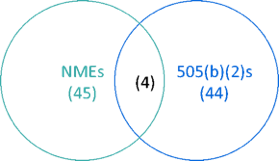
这4个505(b)(2)途径批准的新药为:
Cholbam(胆酸)
用于治疗儿童和成人单一合成酶缺陷导致的胆汁酸合成障碍和过氧化物酶障碍的联合治疗。
获得优先审评和罕见病授权(7年市场独占权),同时获得罕见儿科疾病优先审评劵。
Xuriden(尿苷三乙酸酯)
用于治疗遗传性乳清酸尿症;
获得优先审评、重大突破项目和罕见病药物认定,同时获得罕见儿科疾病优先审评劵。
Avycaz
固定剂量复方药物,由头孢类抗生素头孢他啶和一种新型的β-内酰胺酶抑制剂阿维巴坦(Avibactam)组成,因为含有阿维巴坦,所以Avycaz分类为新化学实体药物(NME);
与甲硝唑联用治疗成人复杂性腹腔内感染;治疗复杂性尿路感染,包括肾盂肾炎;
进入快速通道和优先审评;
为第五代抗生素,按照GAIN法案被认定为对抗重度或者威胁生命的感染的抗生素产品(QIDP),可获得除了上述优先审评权以外的5年市场独占权。
Aristada(阿立哌唑)
非典型精神病药物,用于治疗精神分裂症。
每个505(b)(2)途径申报都会被划分到一个化学分类中,比如新化学实体或者新剂型,两者都赋予药物创新性。排名前三的分类与往年类似,新生产商占41%、新剂型占30%、新复方占16%,新化学实体的比例比往年有所增加,占比从2.4%上升至9%。
医疗器械 医疗器械网 引流袋 尿袋 集尿袋 医疗耗材 医疗耗材




